根據(jù)國(guó)家衛(wèi)健委《關(guān)于印發(fā)涉及人的生命科學(xué)和醫(yī)學(xué)研究倫理審查辦法的通知》(國(guó)衛(wèi)科教發(fā)〔2023〕4號(hào))精神��,所有涉及人的生物醫(yī)學(xué)研究項(xiàng)目在實(shí)施前�����,需要在國(guó)家醫(yī)學(xué)研究登記備案信息系統(tǒng)(以下簡(jiǎn)稱備案系統(tǒng),網(wǎng)址:https://www.medicalresearch.org.cn)登記備案�����。為此,廣醫(yī)二院藥物臨床試驗(yàn)機(jī)構(gòu)從2023年7月1日起���,將組織在本院開展的符合要求的藥物/醫(yī)療器械臨床試驗(yàn)項(xiàng)目進(jìn)行備案����。
一�����、備案范圍:
2023年7月1日后新立項(xiàng)的�,或者在2020年-2023年7月1日期間結(jié)題或仍在進(jìn)行的,且以本院為組長(zhǎng)單位及在本院?jiǎn)沃行拈_展的注冊(cè)類藥物/醫(yī)療器械臨床試驗(yàn)����。
二、注意事項(xiàng):
熟練掌握“醫(yī)學(xué)研究登記備案信息系統(tǒng)”https://www.medicalresearch.org.cn/login
設(shè)立單位科學(xué)審查委員會(huì)�����,并在系統(tǒng)備案
設(shè)立單位倫理委員會(huì)��,并在系統(tǒng)備案
根據(jù)需要是否需要設(shè)立學(xué)術(shù)委員會(huì)(研究者發(fā)起的臨床研究非必需���,但是臨床藥物實(shí)驗(yàn)�����、干細(xì)胞/體細(xì)胞備案均需要)
三����、備案流程:
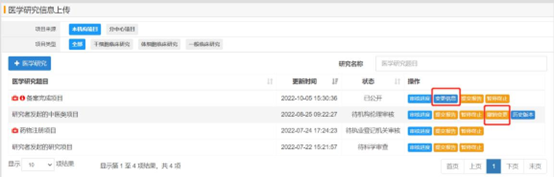
醫(yī)學(xué)研究信息填寫
項(xiàng)目負(fù)責(zé)人新增研究項(xiàng)目或編輯研究項(xiàng)目時(shí),需要依次填寫項(xiàng)目的各項(xiàng)信息���;
![]()
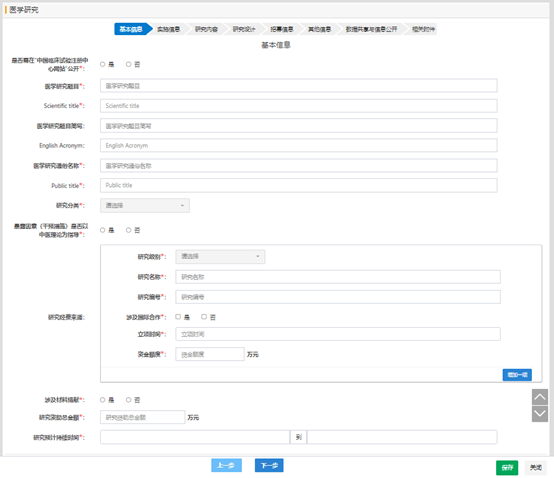
如果有發(fā)文的需求��,需要將項(xiàng)目信息同步到中國(guó)臨床試驗(yàn)注冊(cè)中心時(shí)��, 是否需在“中國(guó)臨床試驗(yàn)注冊(cè)中心網(wǎng)站”公開的選項(xiàng)選“是”��,填寫各項(xiàng)需要的英文信息�,后續(xù)備案完成后���,會(huì)將項(xiàng)目信息同步至中國(guó)臨床試驗(yàn)注冊(cè)中心�����;如果英文信息填寫不對(duì)����,或英文信息中填寫中文信息��,都將不會(huì)同步�。
“暴露因素(干預(yù)措施)是否以中醫(yī)理論為指導(dǎo)”選“是”時(shí),默認(rèn)為中醫(yī)類項(xiàng)目��,提交審核時(shí)�,試點(diǎn)省份(目前十二個(gè)試點(diǎn)省份(第一批試點(diǎn)省份:北京、上海���、廣州�����、海南����;第二批試點(diǎn)省份: 河北���、 遼寧����、 江蘇、浙江����、 山東、 湖南���、 重慶����、 四川))需要進(jìn)行學(xué)術(shù)審核����。
實(shí)施單位默認(rèn)為項(xiàng)目負(fù)責(zé)人所在的單位,如果項(xiàng)目負(fù)責(zé)人在其他機(jī)構(gòu)開展的臨床研究�����,可以根據(jù)情況變更項(xiàng)目的實(shí)施單位���。
對(duì)于多中心項(xiàng)目備案時(shí)��,臨床研究分中心選擇“有” ���,參與單位可以添加多個(gè)���,輸入機(jī)構(gòu)名稱或項(xiàng)目負(fù)責(zé)人時(shí),會(huì)有自動(dòng)提示�����,有名稱匹配的盡量通過(guò)下拉選擇�,這樣分中心及分中心負(fù)責(zé)人���,登錄后會(huì)直接查看到項(xiàng)目��;如果手動(dòng)輸入�,則匹配不到信息��,分中心及分中心負(fù)責(zé)人看不到該項(xiàng)目的信息���。
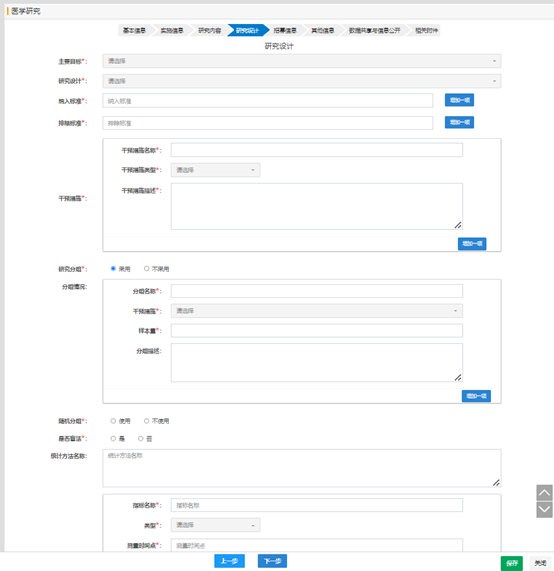
對(duì)于干預(yù)性研究�,需要填寫研究自評(píng)價(jià)的信息���。
項(xiàng)目的學(xué)科分類和 ICD11 分類�����,請(qǐng)根據(jù)研究項(xiàng)目的所主要治療或觀察的相關(guān)疾病信息�����,進(jìn)行選擇���。
研究的具體疾病或癥狀��,不用填寫太多無(wú)關(guān)的信息�����,只要填寫相關(guān)的疾病名稱或癥狀信息即可���。
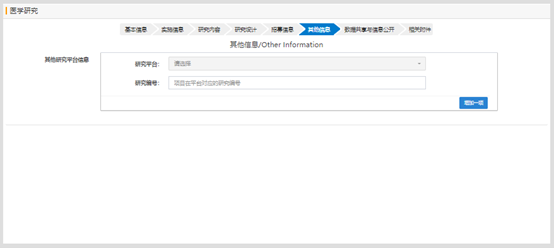
當(dāng)“研究分組”選擇有時(shí), 分組中的干預(yù)措施需要選擇����,否則提交時(shí)會(huì)有錯(cuò)誤提示信息。
研究項(xiàng)目的招募信息填寫:
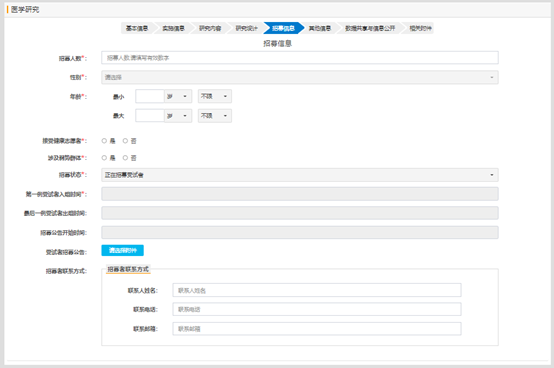
研究項(xiàng)目如果在其他平臺(tái)進(jìn)行注冊(cè)過(guò)����,需要選擇平臺(tái)并填寫對(duì)應(yīng)平臺(tái)的研究編號(hào);如果沒有�����,則不需要填寫;如果選擇了平臺(tái)����,不填寫編號(hào)的話,提交時(shí)�����,會(huì)提示信息不齊��,提交失敗����。
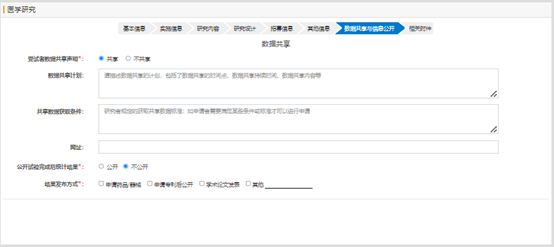
相關(guān)附件部分�����,需要上傳研究方案��、知情同意書模板或知情同意豁免申請(qǐng)書����,
醫(yī)學(xué)研究信息提交
確認(rèn)項(xiàng)目信息填寫無(wú)誤后����,需要項(xiàng)目負(fù)責(zé)人�����,點(diǎn)擊“提交” 按鈕���,提交研究項(xiàng)目審核����,授權(quán)人是不能提交審核的�����,會(huì)出現(xiàn)提交失敗的提示����。如果提交時(shí)出現(xiàn)信息失敗提示,請(qǐng)按照提示信息進(jìn)行補(bǔ)充�����,補(bǔ)充完畢后��,方可提交。
研究者提交時(shí)��,不需要選擇學(xué)術(shù)委員會(huì)審核��,只需要選擇倫理委員會(huì)(倫理辦聯(lián)系電話:34153599)進(jìn)行審核����。
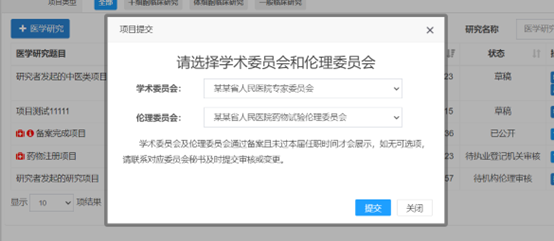
常見的提示說(shuō)明
1、 干預(yù)性研究需要有醫(yī)師
干預(yù)性研究需要項(xiàng)目負(fù)責(zé)人為醫(yī)師�����,或者團(tuán)隊(duì)成員中有醫(yī)師����;如果確認(rèn)團(tuán)隊(duì)中有醫(yī)師的話�,需要在醫(yī)師的個(gè)人信息里,職稱選擇衛(wèi)生技術(shù)人員�����,主任醫(yī)師���、副主任醫(yī)師�����、主治醫(yī)師�、醫(yī)師、醫(yī)士中的任一個(gè)�,方可提交。
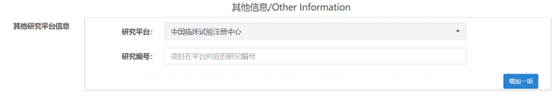
2���、 項(xiàng)目在平臺(tái)對(duì)應(yīng)的研究編號(hào)為空
如果項(xiàng)目在其他信息里選擇了研究平臺(tái)的話���,就需要填寫對(duì)應(yīng)的編號(hào),如果不填寫編號(hào)進(jìn)行提交的話�,就會(huì)出現(xiàn)上面的提示信息,如下圖所示:
項(xiàng)目變更
項(xiàng)目信息備案完成后�,可以進(jìn)行變更,審核完成的項(xiàng)目進(jìn)行變更時(shí)�����,將記錄歷史版本信息��,方便后續(xù)對(duì)比查看���;當(dāng)信息表更后����,未經(jīng)機(jī)構(gòu)審核前,可以選擇“撤銷變更”���,還原信息到上一個(gè)版本���,如下圖所示